化学基礎:物質編1 確認テスト1

解説
他の物質が混ざっていない「純物質」、何種類かの物質が混ざり合った「混合物」


演習1は、純物質と混合物に分類する問題です。

まず、純物質と混合物の意味を確認しておきましょう。
「純物質」 とは、他の物質が混ざっていないものでした。
それに対して、 「混合物」 は、「何種類かの物質が混ざり合った」ものです。
2つの区別をはっきりとしておくことが、とても重要です。

それでは、実際に「石油・塩酸・鉄・アンモニア・食塩水」の5つを、純物質と混合物に分けましょう。

まずは、 ア 石油 です。
石油は、色んな液体(有機化合物)からできていました。
何種類かの物質から出来ているのですから、 混合物 ですね。

次に、 イ 塩酸 です。
塩酸がどのようにしてできているかわかりますか?
実は、 塩酸は塩化水素という気体が水に溶けたもの です。
つまり、塩酸は、何種類かの物質が混ざってできています。
ということは、塩酸は 混合物 ですね。
この問題は、間違える生徒がとても多い問題です。
試験でも狙われやすいので、絶対に覚えておきましょう。

続いて、 ウ 鉄 です。
鉄は、鉄という一種類の金属からできています。
したがって、鉄は 純物質 です。

それでは、 エ アンモニア です。
アンモニアといえば気体ですね。
アンモニアは1種類の物質からできている気体です。
したがって、アンモニアは 純物質 です。
ちなみに、この問題が「アンモニア水」となっていたら、どうでしょうか?
アンモニア水は、アンモニアと水が混ざったものです。
したがって、アンモニア水は混合物ですね。
アンモニアとアンモニア水を区別しておきましょう。

最後に、 オ 食塩水 です。
食塩水は、これまでにも出てきましたね。
食塩水は、食塩と水が混ざったものです。
したがって、食塩水は 混合物 です。

それでは、答えを確認しておきます。
純物質は、 ウ・エ です。
混合物は、 ア・イ・オ です。

純物質と混合物を分類する問題はテストによく出ます。
しっかりと確認しておきましょう。

問題

解説

演習2を解いていきます。
こちらは、混合物を分離する操作に関する問題です。
①~③を行うために、適切な操作を選びましょう。

まず、選択肢に与えられた操作の名前はちゃんと覚えていますか?
いずれも大事な操作なので、分からないものがあったらしっかりと復習しておきましょう。
「蒸留」とは、溶液(固体+液体)から液体を分離する操作


それでは ①「海水から純水を取り出す」 です。
海水は、水や塩、その他の物質からなる混合物です。
海水から純水を分離するのに用いる操作はどれでしょうか?
みなさんは、蒸留と分留で悩んだのではないかと思います。
名前も仕組みも似ているので、きちんと整理しておかないといけません。

まず、 蒸留 は、 「固体と液体の混合物」 から、液体だけを取り出す操作でした。
食塩水から純水を取り出すイメージでしたね。

それに対して、 分留 は 「溶液(2種類以上の液体)」 から液体を分離する操作でした。
石油から様々な燃焼を取り出すイメージでしたね。

さて、①の内容に戻りましょう。
海水は、食塩などが純水に混ざったものでした。
つまり、食塩水は、 固体と液体の混合物 です。
固体と液体の混合物から液体を分離する操作は、どちらでしたか?
答えは、 ア 蒸留 です。
「再結晶」は、温度変化による物質が溶ける量の差を利用

続いて、 ②「硝酸カリウムと塩化ナトリウムの混合物から、硝酸カリウムを取り出す」 です。
注目するのは、 「水への溶けやすさ」 です。

まず、硝酸カリウムは、溶液の温度が高くなればなるほど溶けやすくなる物質でしたね。
一方、塩化ナトリウムは、温度が上がっても溶けやすさはあまり変わりません。

このように、水への溶けやすさ( 溶解度 )に差があると、温度を急激に下げることで硝酸カリウムの結晶を取り出せます。
この操作を、 エ 再結晶 といいました。
「昇華法」は、「固体同士の混合物」の中から、昇華しやすい固体を分離する操作

最後に、 ③「ヨウ素と砂の混合物からヨウ素を取り出す」 です。
固体であるヨウ素と砂の混合物から、ヨウ素のみを取り出すのは、一見難しそうに見えますね。
しかし、ヨウ素の性質を利用して、分離することができました。
その性質とは、 昇華しやすい というものです。
つまり、ヨウ素は加熱によって、固体からいきなり気体になってしまうのでしたね。
一度気体にしてから、冷やして固体を回収する操作は、 オ 昇華法 でした。

どれもテストでよく問われる内容です。
しっかりと区別しておきましょう。

物質と元素
ポイント


今回のテーマは、「元素」です。
「元素」とは、物質を構成する基本的な成分

みなさんは元素と聞いても、イメージできないかもしれませんね。
図の左のように、コップに入っている水があるとしましょう。


実は、水は非常に小さな粒からできています。
それを表したのが、図の中央の「H-O-H」と書かれたものです。
中学校でならったかもしれませんが、 「H」は「水素」 、 「O」は「酸素」 を表しています。
つまり、水は、2つの「水素」と1つの「酸素」からできているといえます。
さらに、水を「水素」と「酸素」に分けてみましょう。
その様子が、図の右側にあります。


この場合の「酸素」や「水素」のように、物質を構成する基本的な成分を 「元素」といいます。
私たちの身のまわりには様々な物質がありますよね。
それらはすべて、元素という小さな粒からできているのです。

「元素の周期表」とは、元素をその性質ごとにまとめた表

今回は、元素の種類を覚えていきましょう。
その際に重要なのが、図のような表です。
この表は、元素をその性質ごとにまとめた表です。
これを 「元素の周期表」 といいます。


簡単に表を見ておきます。
表の左上には、 「H」 という文字があります。
これは、 「水素」 を表す記号でしたね。
次に、右上には、 「He」 と書かれています。
これは、 「ヘリウム」 を表す記号です。
このように、元素の名前は長いので、表の中には書き表せません。
そこで、元素を記号で表すことにしたのですね。
このような記号を 「元素記号」 といいます。
元素の覚え方は、「水兵リーベ、ぼくの船、なな曲がる、シップスクラークか」


それでは、元素の覚え方を紹介していきます。
とはいえ、この表すべてを覚えるわけではありません。
高校の化学では、20個目までを正確に覚えることが重要なのです。
それでは、 1個目から20個目まで を、順番に書き並べてみましょう。

H He Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar K Ca

さぁ、みなさんは、この記号を見ているだけで覚えられますか?
覚え方のコツとして、語呂合わせを紹介しましょう。

水兵リーベ、ぼくの船、なな曲がる、シップスクラークか

それでは、どの文字がどの元素記号を表しているのか確認しておきましょう。

水・・・H(水素)
兵・・・He(ヘリウム)
リー・・・Li(リチウム)
ベ・・・Be(ベリリウム)
ぼ・・・B(ホウ素)
く・・・C(炭素)
の・・・N(窒素),O(酸素)
ふ・・・F(フッ素)
ね・・・Ne(ネオン)
なな・・・Na(ナトリウム)
まがる・・・Mg(マグネシウム),Al(アルミニウム)
シップス・・・Si(ケイ素)、P(リン)、S(硫黄)
クラーク・・・Cl(塩素)、Ar(アルゴン)、K(カリウム)
か・・・Ca(カルシウム)


元素は、高校の化学の基本です。
この機会にきちんと覚えてしまいましょう。
ポイント


今回のテーマは、「化合物と単体」です。

ここまで、元素について学んできました。
元素を理解できれば、 物質の新たな分類 ができるようになります。
物質を分類するには、元素記号で表してみる

それでは、水を例に考えてみましょう。
水は、2個の水素と1個の酸素からなる物質でしたね。
これを元素記号で表すと、 「H2O」 となります。

それに対して、水素や酸素は、どのようにあらわされるでしょうか?
水素の元素記号は、「H」でした。
しかし、酸素原子は1つだけで存在しているわけではありません。
水素は通常、水素原子が2つくっついた状態で存在しているのです。
これを水素分子と呼びます。
したがって、水素分子は 「H2」 と表せます。

次に、酸素の表し方を考えましょう。
酸素の元素記号は、「O」です。
しかし、酸素も水素と同じように、酸素原子が2つくっついた状態で存在しているのです。
これが酸素分子です。
酸素分子は 「O2」 と表せます。

それでは、水・水素・酸素の表し方を整理しておきます。
水・・・H2O
水素・・・H2
酸素・・・O2
2種類以上の元素からなる「化合物」


ここでようやく、物質の分類の話に戻ってきます。
みなさんは、これら3つの物質を2つのグループに分けることができますか?
注目するのは、物質を構成する元素の種類です。

まず、水(H2O)を見てみましょう。
水は、「H」と「O」という、2種類の元素からできていますね。
このように、 2種類以上の元素からなる物質 を 化合物 といいます。
1種類の元素からなる「単体」

それに対して、水素(H2)は、「H」だけでできています。
また、酸素(O2)も、「O」だけでできています。
このように、 1種類の元素からなる物質 を 単体 といいます。


化合物と単体をきちんと区別しておきましょう。
練習

解説

練習問題を解いてみましょう。
元素記号の覚え方は、「水兵リーベ、ぼくの船、なな曲がる、シップスクラークか」


まずは、(1)です。
(1)は、①から⑤の元素の元素記号を答える問題です。
ただ、元素記号を覚えるのは大変です。
このような問題では、次のゴロ合わせを思い出しましょう。
水兵リーベ、ぼくの船、なな曲がる、シップスクラークか

①水素
「水兵リーベ」の"す"でした。
答えは H です。

②炭素
「ぼくの」の"く"の部分です。
答えは C です。

③酸素
「ぼくの」の"の"の母音の部分ですね。
答えは O です。

④ナトリウム
「なな曲がる」の"なな"の部分です。
答えは Na です。

⑤塩素
「シップスクラーク」の"クル"の部分ですね。
答えは Cl です。
少し難しいかもしれませんが、しっかり確認しておきましょう。

2種類以上の元素からなる「化合物」、1種類の元素からなる「単体」


続いて、(2)です。
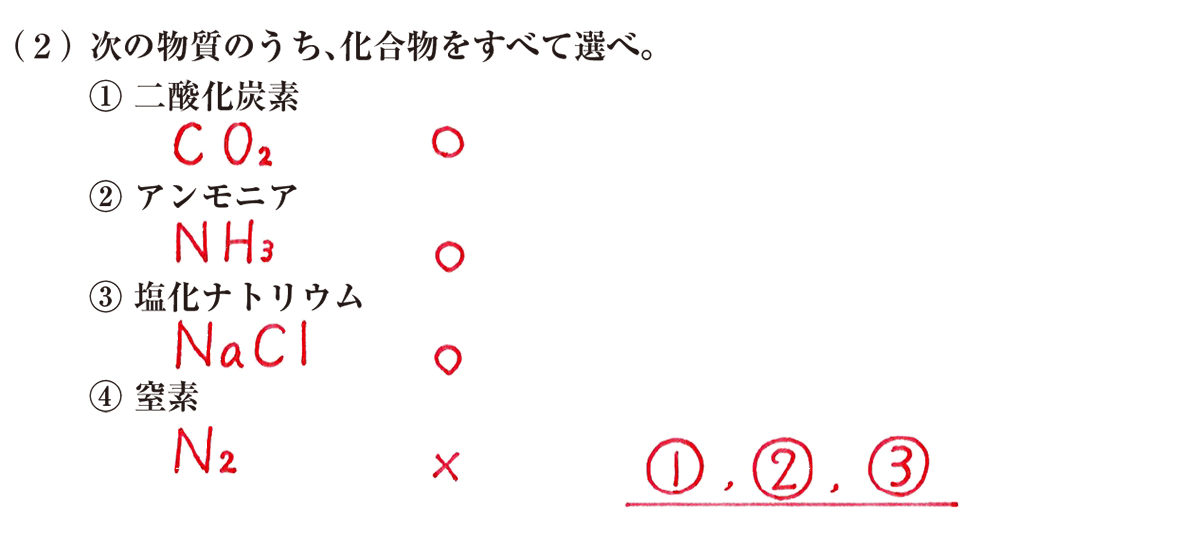
(2)は、①から④の物質のうち、化合物であるものを全て選ぶ問題です。
化合物 とは、 二種類以上の元素から成る物質 のことでしたね。
ちなみに、 単体 は、 1種類の元素からなる物質 のことでした。
化合物や単体をみやぶるためには、問題の物質を元素記号で表すのが大事です。

①二酸化炭素 CO2
②アンモニア NH3
③塩化ナトリウム NaCl
④窒素 N2

このうち、二種類以上の元素から成っているのは①と②と③です。
④は一種類の物質から成るので、単体です。
よって、答えは、 「①、②、③」 です。
同素体
ポイント


今回のテーマは、「同素体」です。

同じ元素でできている物質について、その特徴を注目していきましょう。
まずは、図を見てください。
「同素体」は、同じ元素からなる単体で性質の異なるもの


図の左には、鉛筆がかかれていますね。
鉛筆の芯には、 黒鉛 が使われています。
一方、図の右には、指輪がかかれています。
ダイヤモンド がついていますね。
今回は、黒鉛とダイヤモンドの違いに注目しましょう。
黒鉛とダイタモンドは、 まったく性質が異なります。
しかし、実は、黒鉛とダイヤモンドは、 同じ炭素元素から出来ている のです。
このように、 同じ元素からなる単体で性質の異なるもの を、 「同素体」 といいます。
同素体の覚え方はSCOP、硫黄(S)、炭素(C)、酸素(O)、リン(P)

同素体をもつ元素は、炭素を含めて4種類あります。
硫黄(S)、炭素(C)、酸素(O)、リン(P) です。
元素記号で表すと、 「SCOP」 となります。
「スコップ」 と覚えましょう。

ポイント


今回のテーマは、「いろいろな同素体」です。

「同素体」 とは、同じ元素からなる単体で性質の異なるものでしたね。
硫黄(S)、炭素(C)、酸素(O)、リン(P) のような種類がありました。
それぞれの元素にはどのような同素体があるか、考えていきましょう。
硫黄(S)の同素体は、「斜方硫黄」・「単斜硫黄」・「ゴム状硫黄」


まずは、 硫黄(S) です。
硫黄には、3種類の同素体があります。

図の左は、 「斜方硫黄」 です。
常温で安定している固体の結晶です。
図の真ん中は、 「単斜硫黄」 です。
こちらは針のような形をした結晶です。
図の右は、 「ゴム状硫黄」 です。
ゴムのような弾力をもっています。

これらの3種類のうち、特に「斜方硫黄」と「単斜硫黄」は間違えやすいです。
図のイメージとともに、きちんと整理しておきましょう。
炭素(C)の同素体は、「黒鉛」・「ダイヤモンド」・「フラーレン」


2つ目は、 炭素(C) です。
炭素についても、3種類の同素体を紹介します。

図の左は、 「黒鉛」 です。
電気伝導性があり、比較的軟らかい物質です。
図の真ん中は、 「ダイヤモンド」 です。
ダイヤモンドは非常に硬い物質でしたね。
図の右は、 「フラーレン」 です。
見慣れない物質かもしれませんが、サッカーボールの形として覚えておきましょう。
酸素(O)の同素体は、「酸素」・「オゾン」


3つ目は、 酸素(O) です。
酸素については、2種類の同素体を紹介します。

図の左は、 「酸素」 です。
私たちが呼吸のときに使う気体ですね
酸素は無色・無臭の気体です。
図の右は、 「オゾン」 です。
「オゾン層」として聞いたことがあるのではないでしょうか?
オゾンは、淡青色で刺激臭のある気体です。
「酸素」と「オゾン」では、性質が全く違っていますね。
リン(P)の同素体は、「黄リン」・「赤リン」


4つ目は、 リン(P) です。
リンについても、2種類の同素体を紹介します。

図の左は、 「黄リン」 です。
黄リンは、ビンに入れられ、水中で保存されていますね。
黄リンは沸点が低く、空気中では 自然発火 することもあります。
それを防ぐために、水中で保存しているわけです。
図の右には、 「赤リン」 があります。
赤リンは自然発火しないため、空気中で保存されます。
みなさんは、 マッチ箱の側面 に赤い部分があるのを知っていますか?
私たちは、あの部分にマッチをこすり付けて火をおこします。
そこに、赤リンは利用されているのです。
もし、赤リンが自然発火するとしたら、マッチの箱が勝手に燃えて危険ですよね。

練習

解説

練習問題を解いていきましょう。
同素体とは、同じ元素からなる単体で性質の異なるものでしたね。
「同素体」は、同じ元素からなる単体で性質の異なるもの


まずは、(1)です。
「同じ元素からなる単体で性質の異なるもの」 を何というか、答える問題です。
例として、黒鉛とダイヤモンドが挙げられています。
黒鉛とダイヤモンというところでピンときて欲しいですね。
答えは、 「同素体」 です。

同素体の種類は、硫黄(S)、炭素(C)、酸素(O)、リン(P)


続いて、(2)です。
(2)は、同素体の組合せを選ぶ問題です。
順番に確認していきましょう。

ア 斜方硫黄と単斜硫黄
斜方硫黄と単斜硫黄は、どちらも硫黄の同素体です。
図のイメージで覚えておきましょう。
よって、 アは同素体です。

イ フラーレンと二酸化炭素
みなさんは、フラーレンと聞いて、イメージできますか?
フラーレンは、サッカーボールのような形をしている物質でした。
炭素の同位体でしたね。
それに対して、二酸化炭素はどうでしょうか?
確かに、二酸化炭素は炭素を含んでいます。
しかし、酸素まで含んでしまっていますね。

ここで、もう一度同素体の定義を確認しておきましょう。
同素体とは、同じ元素からなる単体で性質の異なるものでした。
「単体」 というところがポイントです。
単体とは、1種類の元素からなる物質でしたね。
それに対して、二酸化炭素は2種類以上の物質からなる 「化合物」 です。
したがって、二酸化炭素が同素体になることはありません。
ここはとても重要なので、きちんと理解しておきましょう。
よって、 イは同素体ではありません。

ウ 水素とオゾン
オゾンといえば、酸素の同素体として有名でした。
淡青色で刺激臭のある気体でしたね。
というわけで、「酸素とオゾン」の組合せなら正解となります。
しかし、この問題は「水素とオゾン」となっているので、誤りです。
よって、 ウは同素体ではありません。

エ 黄リンと赤リン
黄リンと赤リンは、リンの同素体として有名でしたね。
ちなみに、自然発火するのは、黄リンのほうでしたね。
性質も含めて覚えておきましょう。
よって、 エは同素体です。

以上より、答えは 「ア、エ」 となります。

炎色反応と沈殿
ポイント


今回のテーマは、「炎色反応」です。

突然ですが、みなさんは 花火 を見たことがあるでしょうか?
花火では、赤や黄、緑といった様々な色の光が発生し、夜空を彩ります。
しかし、みなさんは、これらの色がどのようにして発生しているか、知っていますか?
実はこの現象に深く関係しているのが、 「炎色反応」 という化学反応です。
今回は、炎色反応について、学習していきましょう。
炎色反応は、特定の元素+炎⇒特有の色

それでは、炎色反応について、学習していきましょう。
まず、言葉の意味から確認しておきます。
炎色反応とは、「炎の色の反応」と書きますよね。
その名の通り、 「特定の元素を炎にいれると、特定の色を示す」 というです。
実際にどのように反応を観察するのか、確認していきましょう。

まず、ガスバーナーを用意します。
そのガスバーナーで炎を発生させ、炎が青色になるように酸素の量を調節します。
その後、その炎の中に 特定の元素が含まれる溶液 を入れてみましょう。
すると、下の図のように、溶液を反応させたところから、 炎の色が赤色や黄色に変わる のです。
これが 「炎色反応」 というものです。


ちなみに、炎の中に溶液を入れるためには、棒のようなものを使う必要がありますね。
このときに使うのが、 「白金線」 というものです。
白金は、プラチナとも呼ばれるます。
プラチナといえば、指輪等に使われる金属で、化学反応を起こしにくいことで有名です。
そのため、余計な化学反応を起こさないので、炎色反応を邪魔しないわけですね。
炎色反応は、元素ごとに色が異なる

さて、炎色反応で現れる炎の色は、溶液に含まれる元素の種類によって変わります。
「どの元素がどの色の炎を発生させるのか」 がとても重要なので、順番に確認していきましょう。

まず、溶液にLi(リチウム)が含まれていた場合を考えます。
下の図を見てください。
このとき、赤色の炎が発生しています。
他の元素の場合を、順番に確認していくと、元素と色の関係は次のようになります。

Li(リチウム) 赤色
Na(ナトリウム) 黄色
K(カリウム) 紫色
Cu(銅) 青緑色
Ba(バリウム) 黄緑色
Ca(カルシウム) 橙色
Sr(ストロンチウム) 紅色


みなさんが覚えるのは、この7つです。
しかし、聞き慣れない元素が多く、覚えるのは大変そうですよね。
実は、これらを簡単に覚えられる語呂合わせがあるのです。
炎色反応の覚え方は、『リアカー無きK村で、動力に馬力借ろうとするも、くれない』

炎色反応の覚え方は、次の語呂合わせです。
『リアカー無きK村で、動力に馬力借ろうとするも、くれない』

イメージとしては、「リアカーがない村で馬を借りようとしたけど、借りることが出来なかった」というような内容ですね。
さぁ、この語呂合わせの「どこに元素の名前と色が隠れているか」を確認していきましょう。

リアカー Li(赤)
無き Na(黄)
K村で K(紫)
動力に Cu(青緑)
馬力 Ba(黄緑)
借ろうと Ca(橙)
するも、くれない Sr(紅)


この中だと、Ca(橙)が少し難しいかもしれませんね。
「橙」は 「橙赤色(とうせきしょく)」 のように、「とう」と読みます。
ですから、「借ろうと」と覚えましょう。

また、「Cu(青緑)」と「Ba(黄緑)」が、どちらも緑でややこしいかもしれません。
そんなときは、 「きゅうり(Cu)は青緑」 と覚えておきましょう。
きゅうりの外側が濃い青緑色になっているイメージですね。


さぁ、みなさんは、元素と色の関係について、覚えることができたでしょうか?
最後に、この実験の目的についても解説しておきます。

冒頭で紹介したように、花火は炎色反応を利用して、様々な色の炎を発生させています。
しかし、化学において大事なのは、 「炎色反応によって、その物質に含まれる元素がわかる」 ということなのです。

みなさんの目の前に未知の物質があるとしましょう。
「これは何でできているのか」を調べるために用いるのが、炎色反応という方法なのです。
ポイント


今回のテーマは「沈殿」です。

沈殿というと、あまり聞き慣れない言葉かもしれませんね。
しかし、実は、みなさんも中学のときに学習した内容なのです。
石灰水+二酸化炭素→炭酸カルシウム(沈殿)

まず、図の左を見てください。


集気びんの中に、 石灰水 という液体が入っていますね。
その中で、エタノールなどの物質を燃やしています。
その後、集気びんを振ってかき混ぜると、図の右のように石灰水が 白くにごりました。


みなさんは石灰水が白くにごったのはなぜか、わかりますか?
石灰水が白くにごる反応といえば、 「二酸化炭素」の発生を確かめる実験 でしたよね。
つまり、このときの反応を式で表してみると、次のようになります。
石灰水+二酸化炭素→炭酸カルシウム

この反応によってできた「炭酸カルシウム」は水に溶けにくい物質です。
そのため、石灰水の中で浮遊して、白くにごったように見えるのです。
この場合の「炭酸カルシウム」のように、水に溶けにくい固体を 「沈殿」 といいます。


このように、沈殿が発生したことから、二酸化炭素の発生を確認できることができます。
練習

解説

練習問題を解いていきましょう。
身の回りにある様々な物質に含まれる元素を調べる方法に関する内容ですね。
炎色反応は、特定の元素+炎⇒特有の色


(1)は、文章で示された反応の名前を答える問題です。
物質を炎の中に入れると、 その元素に特有の色 を発することがありました。
この反応を 「炎色反応」 というのでした。
「炎の色の反応」と書くので、わかりやすいですね。

炎色反応の覚え方は、『リアカー無きK村で、動力に馬力借ろうとするも、くれない』


(2)は、炎色反応において、元素の種類と色の関係を考える問題です。
炎色反応の語呂合わせを覚えていれば簡単です。
『リアカー無きK村で、動力に馬力借ろうとするも、くれない』 でしたね。

この実験では、 『黄色』の炎 が現れました。
ということは、語呂合わせの中で、『黄色』がどこに登場するかを考えましょう。
「無き」 の部分が 「Na(ナトリウム)黄」 でしたね。
つまり、黄色い炎から確認できる元素は、ナトリウムです。
しかし、問題には「元素記号で答えよ」と書かれていますね。
そのため、答えは Na となります。

「元素名」と「元素記号」のどちらで答えるのか、注意しておきましょう。

石灰水+二酸化炭素→炭酸カルシウム(沈殿)


(3)では、「石灰水に二酸化炭素を吹きかけると、炭酸カルシウムが発生して白くにごる」とあります。
石灰水がにごるのは、 水に溶けない物質 できるからでしたね。
この反応を簡単な式で表すと、次のようになります。
石灰水+二酸化炭素→炭酸カルシウム
この場合の炭酸カルシウムのように、水に溶けない固体のことを 沈殿 というのでした。

確認テスト2

解説

今回は確認テストです。
試験に出やすい問題を解きながら、前回までの内容を復習していきましょう
純物質と混合物の区別では「物質の種類」

まずは、演習1です。
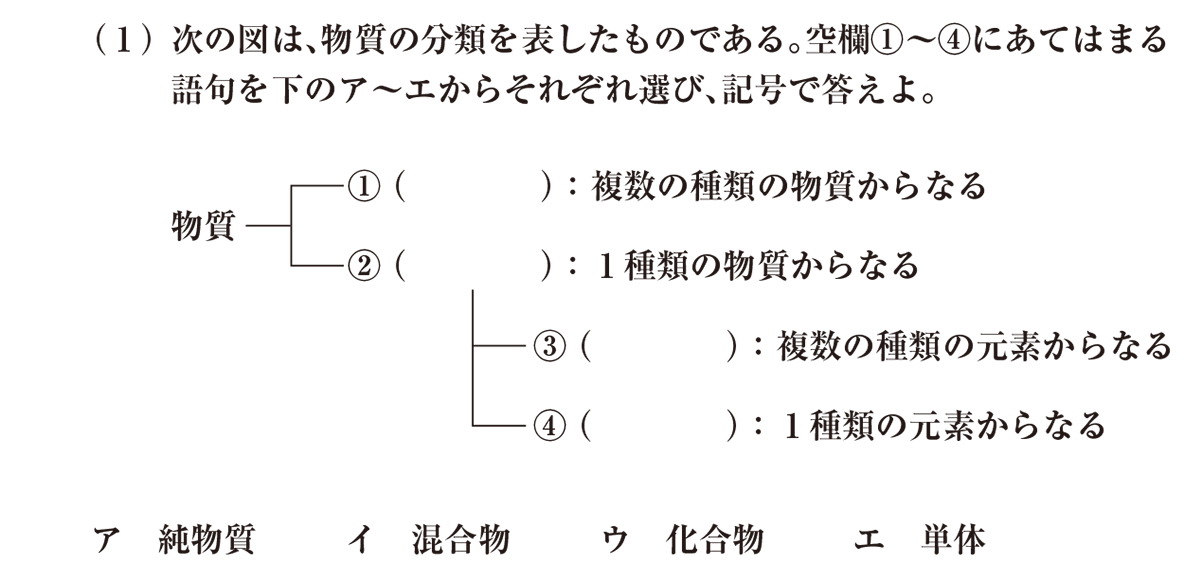
(1)は、純物質と混合物など、物質の分類する用語を整理する問題です。
同じような用語が登場しまが、きちんと区別できていますか?
①と②は、『物質』の種類に注目した分類

最初に、①と②の違いに注目しましょう。
①には、「複数の種類の物質からなる」とありますね。
②には、「1種類の物質からなる」と書かれています。
つまり、①と②は、 『物質』 の種類に注目した分類なのです。
複数の種類の物質からなる「混合物」

さぁ、①に何があてはまるか考えていきましょう。
このときに重要なのが、①に分類される物質をイメージできるかどうかです。
例えば、授業では、海水を取り上げましたね。
海水は、水や食塩、その他の物質が混ざってできていました。
このように、 複数の種類の物質からなる 物質を 「混合物」 といいました。
したがって、①は、 イ です。
1種類の物質からなる「純物質」

次に②です。
②には、 「1種類の物質からなる」 と書かれています。
食塩を思い出しましょう。
海水と違って、食塩は1種類の物質からできていましたね。
このように、1種類の物質からなる物質を 「純物質」 といいました。
よって、②は、 ア です。
③と④は、『元素』の種類に注目した分類


さらに、②が③と④に分かれていますね。
③と④にあてはまる用語を考えていきましょう。
今回も、③と④の違いに注目します。
③は、「複数の種類の元素からなる」と書かれています。
④は、「1種類の元素からなる」とありますね。
つまり、③と④は、 『元素』 の種類に注目した分類なのです。
複数の種類の物質からなる「化合物」

それでは、③について考えていきます。
イメージするのは、「水」です。
元素の種類に注目するということは、化学式で表すのが重要です。
水を化学式で表すと、「H2O」となります。
つまり、水は「H(水素)」と「O(酸素)」の 2種類の元素からなる わけです。
このような物質を、 「化合物」 といいましたね。
よって、答えは、 ウ です。
1種類の元素からなる「単体」

最後は、④です。
④は、「1種類の元素からなる」とあります。
例えば、「H2(水素)」や「O2(酸素)」は 1種類の物質からできていますね。
このような物質を 「単体」 といいます。
したがって、答えは エ です。

「酸素」という言葉は、「単体」として使われている場合と「元素」として使われている場合がある


続いて、(2)です。
(2)は、「酸素」という言葉が、 「単体」と「元素」のどちらの意味で用いられているのか を問う問題です。

問題を見たとき、「単体と元素って同じじゃないの?」と思った人もいるのではないでしょうか。
しかし、この使い分けには、きちんとしたルールがあります。
まず、アを例に、見分け方を学習しましょう。
「単体」と「元素」のどちらの意味かを見分けるには、直前に『単体の』を入れてみる

ア「生物は呼吸によって、酸素を取り込んでいる。」を例に紹介していきます。
傍線部の「酸素」の手前に、 『単体の』 という言葉を入れてみましょう。
すると、「生物は呼吸によって、 『単体の』 酸素を取り込んでいる。」となりますね。
単体の酸素といえば、 O2 のことでした。
「生物は呼吸によって、 O2 を取り込んでいる。」と表しても問題ありませんね。
したがって、 アの「酸素」は「単体」の意味 で用いられています。

以上のように、見分け方の手順は、次の通りです。
①「酸素」の前に、『単体の』という言葉を入れてみる。
②改めて文章全体を読んでみて、意味が通っているかどうかを確認する。


この方法を使って、イ~エをチェックしていきましょう。

イ「空気中に酸素は、約20%含まれる。」
この場合は、どうでしょうか?
「酸素」の前に、『単体の』という言葉を入れてみましょう。
「空気中に 『単体の』 酸素は、約20%含まれる。」
こちらも問題ありませんね。
したがって、 イの「酸素」も「単体」の意味 で用いられています。


ウ「酸素とオゾンは、酸素の同素体である。」
今回も、「酸素」の前に、『単体の』という言葉を入れてみましょう。
「酸素とオゾンは、『単体の』酸素の同素体である。」となりますね。
単体の酸素とは、O2のことでした。
「酸素とオゾンは、O2の同素体である。」となりますね。

ここで注目するのは、左側(下線が引かれていない)「酸素」と「オゾン」です。
「酸素」といえば「O2」です。
「オゾン」といえば「O3」です。
これを文章に入れてみましょう。
「O2とO3は、O2の同素体である。」となりますね。
すると、O2の意味が重なってしまっています。
つまり、下線部の「酸素」は、「単体」の意味ではありません。
ウの「酸素」は「元素」の意味 で用いられているということですね。


エ「水の電気分解により、水素と酸素が得られる。」
今回も、「酸素」の前に、『単体の』という言葉を入れてみましょう。
最後に、エ「水の電気分解により、水素と 『単体の』 酸素が得られる。」
このとき発生するのは、気体の「酸素」です。
O2と言いかえても、問題ありませんね。
したがって、 エの「酸素」も「元素」の意味 で用いられています。

以上より、答えは、 ウ です。

問題

解説

演習2を解いていきましょう。
この問題は、①と②の実験結果から、物質Xの正体を見究める問題です。
①と②の条件を満たさないものを、削っていく のがポイントです。
石灰水+二酸化炭素→炭酸カルシウム(沈殿)


それでは、①の実験から確認していきます。
文章の後半に、 「石灰水に通すと白濁した」 とありますね。
ここが大きなヒントになっています。
石灰水が白濁するのは、沈殿が生じるからでしたね。
この反応に深く関係しているのは、 二酸化炭素 です。

このことから、なんと物質Xの正体を絞ることができるのです。
順を追って考えていきましょう。
まず、二酸化炭素を化学式で表すと、 CO2 となります。
つまり、 「物質Xと塩酸(HCl)が反応して、CO2ができた」 というわけです。
このとき、物質Xが「イ CuSO4」だったらどうなるでしょうか?
CuSO4の中にも、HClの中にも、C(炭素)がありません。
ということは、CuSO4とHClを反応させたところで、CO2は発生しないのです。
これは、「エ CaSO4」の場合も同じです。
CaSO4の中にも、HClの中にも、C(炭素)はありませんね。
しかし、「ア CuCO3」や「ウ CaCO3」の中には、ちゃんとC(炭素)が含まれています。
よって、①から、 答えは、「ア CuCO3」か「ウ CaCO3」のどちらか だとわかります。
炎色反応の覚え方は、『リアカー無きK村で、動力に馬力借ろうとするも、くれない』


つづいて、②を見てみましょう。
②を理解することで、答えが1つに決まるのです。
最初に注目するのは、 「炎色反応を調べた」 という言葉です。
炎色反応といえば、炎の色の変化を利用して、物質に含まれている元素を調べる方法でしたね。
炎が特有の色に変われば、特定の元素が含まれていたことがわかるのでした。
この場合は、 「橙赤色を示した」 とありますね。
つまり、「橙赤色」を示す元素が何か、わかればよいわけです。

ここで大事なのが、元素と色の覚え方です。
みなさんは、語呂合わせを覚えていますか?
「リアカー無きK村、動力に馬力借ろうとするも、くれない」 でしたね。
この中で橙赤色を示すのは、「借ろうと」の部分です。
「Ca(カルシウム)橙赤色」 でしたね。
したがって、炎色反応で橙赤色を示す元素は、Ca(カルシウム)です。
念のため、選択肢に含まれているCu(銅)の色も確認しておきましょう。
注目するのは、「動力」の部分でした。
「Cu(銅)青緑」ですね。

以上より、物質Xには、 Ca(カルシウム)が含まれている ことがわかりました。
あとは、「ア CuCO3」か「ウ CaCO3」のうち、Ca(カルシウム)を含む方を選ぶだけです。
答えは、 「ウ CaCO3」 です。


このように、①と②の2つの条件を満たすものを探すことによって、答えにたどりつくことができるのです。
電子配置
ポイント


今回のテーマは、「電子殻」です。

これまで、原子の構造について学習してきましたね。
その中で今回注目するのは、 「電子」 です。
電子は、原子核のまわりを回っていると学習してきました。
しかし、電子の配置には、もっと細かいルールがあります。
図を見ながら、詳しく学習していきましょう。
電子殻の名前は、内側から順に、K殻・L殻・M殻・N殻


図の左側には、原子の様子を立体的に表した図があります。
これまで見てきた図とは、少し違っていますね。
これまでは、電子が一つの円に沿って回転していました。
しかし、今回の図では、電子が入るところが何重にもなっていますね。

左側の図を簡単に表したのが、図の右側です。
中心には、原子核がありますね。
そのまわりには、何重にも円があります。
この円を、 「電子殻」 と呼びます。
「電子が入る殻」というイメージですね。
図を見ると、内側から順番に、 K殻・L殻・M殻・N殻 と名前がついていることがわかると思います。
「K」から順番にアルファベット順 になっているので、覚えるのは簡単ですね。

内側からn番目の電子殻が含む電子の最大収容数は、2n2個


それでは、どの電子殻に電子が入っていくのか、実際に考えていきましょう。
これまでは、ヘリウム原子を例について考えてきましたね。
ヘリウムには、2個の原子がありました。
この2個は、どちらも最も内側の「K殻」に入ることになります。
このように、 電子は内側の電子殻から順番に入る のです。

ここで注意するのは、 「それぞれの原子殻に入る電子の数には限界がある」 ということです。
もし、限界がなければ、電子はすべてK殻に入ってしまいますよね。
限界があるからこそ、 K殻・L殻・M殻・N殻の順に埋まっていくのです。


さぁ、ここで図に戻りましょう。
図の円には、それぞれ数字がついていますね。
K殻には「2」とあります。
これは、「K殻には2個まで電子が入る」ということです。
同じように、「L殻には8個まで電子が入る」、「M殻には18個まで電子が入る」、「N殻には32個まで電子が入る」ということになります。
これを 「電子の最大収容数」 と呼んでおきます。

このように、電子の最大収容数には、ルールがあります。
しかし、少し数字が多くて、覚えるのが大変ですね。
少し整理してみましょう。
K殻(1周目)2個
L殻(2周目)8個
M殻(3周目)18個
N殻(4周目)32個

さらに、「周目」と「個」の関係を式で表してみましょう。
K殻(1周目) 2=2×12
L殻(2周目) 8=2×22
M殻(3周目) 18=2×32
N殻(4周目) 32=2×42
このように表してみると、みなさんにも規則性がわかってきたのではないでしょうか?
n周目 の場合、電子の最大収容数は、 2n2個 になっていますね。
このようにして、電子の最大数を覚えておきましょう。

ポイント


今回のテーマは、「電子配置」です。
電子配置は、電子がどのように配列されているか


これまで、 電子殻 について学んできました。
電子殻のポイントは、それぞれの電子殻に収容される 電子の最大収容数 でしたね。
しかし、原子によって、もっている電子の数が異なるため、電子の収容され方にも違いがあります。
このように、 「電子がどのように配列されているか」 を 「電子配置」 といいます。
電子配置をどのように表すのか、具体的な原子を例に考えていきましょう。

電子配置のコツは、①内側から埋まっていく、②電子の最大収容数が決まっている


まずは、Li(リチウム)です。
Liがもつ電子の数を調べてから、「どの電子殻に何個の電子が入るのか」と考えていきましょう。

Liの左下には、「3」と書かれています。
この「3」は原子番号を表していましたね。
原子番号が「3」ということは、陽子の数も「3」です。
ここで、原子に含まれる陽子の数と電子の数は同じでしたね。
ということは、 電子の数も「3」 です。

電子の数がわかったら、電子配置を考えていきましょう。
このときに重要なのは、2点です。
①内側の電子殻から順に埋まっていく
②それぞれの殻について、電子の最大数が決まっている
Liの電子配置は「K2,L1」

それでは、実際に考えてみましょう。
Liには3個の電子があります。
これが、内側のK殻から順に埋まっていきます。
しかし、K殻には、2個しか電子が入れませんでしたね。
ですから、残りの1個は、次のL殻に入るわけです。
よって、Liの場合、 K殻に2個、L殻に1個の電子が入る ことになります。
このような電子配置を、 「K2,L1」 と表します。
Cの電子配置は、「K2,L4」

次に、C(炭素)を考えて見ましょう。
Cの左下には、「6」と書かれています。
原子番号が「6」ということは、陽子の数も「6」です。
つまり、電子の数も「6」ですね。

次に電子配置を考えます。
Cには6個の電子があります。
これが、内側のK殻から順に埋まっていきます。
しかし、K殻には、2個しか電子が入れませんでしたね。
ですから、残りの4個は、次のL殻に入るわけです。
よって、Cの場合、 K殻に2個、L殻に4個の電子が入る ことになります。
このような電子配置を、 「K2,L4」 と表します。


電子配置の表し方をおさえておきましょう。
練習

解説

練習問題を解いていきましょう。
図には、原子の模式図がありますね。
内側からn番目の電子殻が含む電子の最大収容数は、2n2個


図には、原子核のまわりに何重にも殻のようなものがかかれています。
それぞれに「K殻」~「N殻」の名前がついていますね。

(1)は、これらをまとめて何というかを答える問題です。
このように、電子を収容した層のことを 「電子殻」 といいましたね。

(2)は、図中の「ア」、「イ」にあてはまる数を答える問題です。
まず、この数が何を表しているかわかりますか?
これは、それぞれの電子殻に収容される電子の最大数でしたね。
覚えるためのコツがありましたよね。
内側からn番目の電子殻に収容される電子は、 2n2 個です。

さて、今聞かれているのは、L殻とN殻の最大収容数でしたね。
まず、L殻は内側から2番目の電子殻です。
ということは、n=2として、最大収容数を求めましょう。
2n2に、n=2を代入すると、2×22となります。
よって、答えは、 「8」 です。

同じように、N殻の最大収容数を求めましょう。
N殻は内側から4番目の電子殻です。
ということは、n=4として、最大収容数を求めましょう。
n=4を代入すると、2×42となります。
よって、答えは、 「32」 です。

電子配置のコツは、①内側から埋まっていく、②電子の最大収容数が決まっている


最後に、(3)です。
まず、問題文の 「電子配置」 という言葉を覚えていますか?
電子配置とは、 「電子がどのように配列されているか」 ということでしたね。
今回は、「例にならって」と書かれていますね。
「例」のC(炭素)から考えてみましょう。

Cの左下には、「6」と書かれていますね。
ということは、Cの原子番号は「6」です。
よって、陽子の数も「6」です。
原子においては、陽子の数と電子の数は同じでしたね。
したがって、 Cの電子の数は「6」 です。
あとは、6個の電子がどのように配置されるかを考えましょう。
電子は、内側にある電子殻から順に埋まっていくのでしたね。
つまり、K殻には、2個の電子が入ります。
そして、残りの4個は、L殻に入ります。
ですから、 「K2、L4」 と表されるわけです。

それでは、本題のO(酸素)について考えてみましょう。

Oの左下には、「8」と書かれていますね。
ということは、Oの原子番号は「8」です。
よって、陽子の数も「8」です。
電子の数も「8」 ですね。
次に、8個の電子がどのように配置されるかを考えましょう。
まず、内側のK殻には、2個の電子が入ります。
そして、残りの6個は、L殻に入ります。
ですから、 「K2、L6」 と表されるわけです。

価電子
ポイント


今回のテーマは、「価電子」です。

みなさんはこれまで、「電子がどの電子殻に入ってくるか」を学んできましたね。
このことを 「電子配置」 といいます。
実は、この電子配置が原子の性質を決めているのです。
詳しく見ていきましょう。
「最外殻電子」とは、最も外の電子殻に収容されている電子


表を見てください。
表には、C(炭素)とF(フッ素)の電子配置が示されています。
この表の空欄を埋めていきましょう。

まず、下から2段目には、「最外殻電子の数」と書かれています。
「最外殻電子」 とは文字通り、 「最も外の電子殻に収容されている電子」 のことです。
Cの場合は、K殻に2個の電子が入っています。
その外側のL殻には、4個の電子がありますね。
このL殻が、Cの場合の「最外殻」にあたります。
つまり、Cの最外殻電子の数は、 「4」 となります。

同じように、Fの最外殻電子の数を考えましょう。
FのK殻には、2個の電子が入っています。
L殻には、7個ですね。
よって、Fの最外殻電子の数は、 「7」 となります。
「価電子」とは、最外殻にある1から7個の電子


次に、一番の下の段を埋めていきましょう。
「価電子の数」とありますね。
「価電子」 とは、 最外殻にある1から7個の電子 のことです。
「価電子」と「最外殻電子」はよく似ていますが、 「1から7個」というところが非常に重要です。

今回のCとFの場合は、どちらも「1から7個」の中に収まっています。
ですから、今回は「価電子の数」と「最外殻電子の数」は同じです。
よって、Cの価電子の数は、 「4」 です。
同様に、Fの価電子の数は、 「7」 となります。


ここまではとても簡単ですね。
しかし、少し特殊な場合があるので、次に確認していきましょう。
ポイント


今回のテーマは、「希ガスの電子配置」です。
希ガスの覚え方は、「変なねえちゃん歩いて来るよ、キセルくわえてランランラン」

これまで同様、 「電子配置」 がテーマになっていますね。
しかし、今回は 「希ガス」 と書かれていますね。
希ガスとは、元素のグループの名前です。

次のような種類があります。
He(ヘリウム)
Ne(ネオン)
Ar(アルゴン)
Kr(クリプトン)
Xe(キセノン)
Rn(ラドン)

希ガスはとても重要な元素なので、この機会に名前を覚えましょう。
覚えるといっても、いきなり丸ごと覚えるのは大変です。
例によって、語呂合わせを使って、覚えてしまいましょう。
「変なねえちゃん歩いて来るよ、キセルくわえてランランラン」
それぞれの元素名は、次のように関連しています。
「変な(He)、ねえちゃん(Ne)、歩いて(Ar)、来るよ(Kr)、キセル(Xe)くわえて、ランランラン(Rn)」
希ガスの価電子は0個

さて、今回のテーマは、「希ガスの電子配置」でしたね。
次の表を見て下さい。


表の左には、希ガスの 元素名 が書かれています。
その右には、 電子殻 が書かれています。
内側から順に、「K殻」「L殻」「M殻」「N殻」でしたね。
例えば、He(ヘリウム)では、K殻に2個の電子が入っています。
Ne(ネオン)では、K殻に2個、L殻に8個の電子が入っていますね。

これらの価電子は、何個になるでしょうか?
みなさん、前回の内容を思い出してください。
「価電子」 とは、最外殻にある 1から7個 の電子のことでした。
Neの最外殻電子は8個でしたね。
この場合、価電子の数は何個になるのでしょうか?
答えは、0個です。
「希ガスの価電子の数は0」 というきまりがあるのです。
ちなみに、Heの最外殻電子の数は2個で、Neのように8個ではありません。
しかし、Heは希ガスなので、「価電子の数は0」と考えることになっています。
「閉殻」とは、最大数の電子が収容された電子殻


これに関連して、左の図を確認してみましょう。
HeとNeの電子配置が表されています。
この2つの原子について、最外殻に注目しましょう。
HeのK殻には2個の電子が入っています。
K殻に収容される電子は、最大で2個でしたね。
つまり、HeのK殻には、最大数の電子が収容されているというわけです。
同じように、NeのL殻には、8個の電子が入っています。
NeのL殻に収容される電子は、最大で8個でしたね。
NeのL殻にも、最大数の電子が収容されています。
このように、最大数の電子が収容された電子殻を 「閉殻」 といいます。

練習

解説

電子配置について、練習問題を解いていきましょう。
図はN(窒素)とNe(ネオン)の原子の模式図です。
「価電子」とは、最外殻にある1から7個の電子


まずは、(1)です。
窒素原子には、最外殻に電子が5つあります。
これらの電子を何というか答える問題です。
このような電子を、 「価電子」 といいました。

大事なのは、「価電子」と「最外殻電子」を、きちんと区別することです。
「最外殻電子」 とは、 最も外側の電子殻に収容された電子 です。
「価電子」 とは、 最外殻にある1から7の電子 のことでした。

希ガスの価電子は0個


続いて、(2)です。
Neの価電子の数を答える問題です。
Neには、8個の最外殻電子があります。
しかし、価電子の数は8個ではありません。
この問題は要注意です。
Neは、希ガスと呼ばれる元素でしたね。
希ガスの価電子は0個 と決められていました。
したがって、答えは 「0」 となります。

「閉殻」とは、最大数の電子が収容された電子殻


次は、(3)です。
NeのL殻には、8個の電子が入っています。
これは、L殻の最大収容数と同じですね。
このような電子殻のことを 「閉殻」 というのでした。

希ガスの覚え方は、「変なねえちゃん歩いて来るよ、キセルくわえてランランラン」


最後に(4)です。
He,Ne,Ar,Kr,Xe,Rn のような元素を何というか答える問題です。
語呂合わせがヒントです。
「変なねえちゃん歩いて来るよ、キセルくわえてランランラン」
これらのことを 「希ガス」 といいました。

あなたもジンドゥーで無料ホームページを。 無料新規登録は https://jp.jimdo.com から
今回は、「確認テスト」です。
これまで学習した内容を、問題を解きながら復習しましょう。
また、ここで取り上げる問題は、テストでもよく出るところです。
しっかりとマスターしておきましょう。